睡眠大脑振荡回路:REM 睡眠核心振荡机制与觉醒调控
随着现代生活节奏加快与社会压力攀升,睡眠 - 觉醒障碍的发病率持续上升,睡眠医学的重要性日益凸显。该领域聚焦睡眠的生物学机制、睡眠相关障碍的病理生理特征、临床评估及防治等核心内容。本文将系统梳理哺乳动物睡眠过程中脑内神经元网络振荡的神经生物学机制,重点解析皮质下结构的调控作用、快速眼动睡眠(REM)的特异性振荡回路,以及睡眠向觉醒过渡的生理过程。
一、皮质下细胞在睡眠振荡中的调控作用
多通道皮质脑电图记录显示,NREM 睡眠启动阶段,大脑的振荡活动在时空维度上展现出显著异质性。额叶新皮质以慢波和低频(<8Hz)振荡为主导,枕叶则伴随 θ 节律活动;此外,人类海马旁区短暂的 1.5-3.0Hz 低频活动,被认为是 NREM 睡眠早期入睡幻觉的神经基础。即便随着 NREM 睡眠深度增加,慢波与纺锤波的额叶优势依然存在,但局部皮质脑电图仍会呈现半球间异步现象,且人类与动物个体内、个体间的振荡差异,以及单个皮质柱不同层级的特异性振荡,已有相关研究报道。
与皮质区域类似,皮质下结构在 NREM 睡眠启动时也表现出强烈的时间活动动态异质性。在人类体内,丘脑与海马会先于新皮质几分钟出现 NREM 睡眠的典型神经活动(如丘脑的慢波活动、海马的纺锤样振荡),随后新皮质才会呈现明确的 NREM 睡眠特征。当进入稳定 NREM 睡眠后,啮齿类动物与人类的额叶皮质中,中线及背侧丘脑神经元的放电率会先于皮质 UP 状态升高,而顶叶皮质无此现象,这一结果既支持了睡眠振荡的区域特异性调控机制,也印证了慢波起源于丘脑的观点。
这些区域特异性的网络振荡变化,与睡眠活跃神经元的全脑解剖分布及睡眠的多中心起源特性相符。对 NREM 睡眠分子机制的初步研究表明,人类与啮齿动物下丘脑视前区及正中视前核中,释放 GABA 或甘丙素的神经元具有睡眠活性;通过活动标记与逆行标记技术,已证实这类神经元参与 NREM 睡眠的启动与维持过程。
尽管多个睡眠活跃系统的存在已得到充分验证,但这些系统如何调控时空维度上的振荡回路,以及如何实现从清醒到 NREM 睡眠的渐进过渡(即 “睡眠开关” 机制),目前仍未完全明确。在此背景下,丘脑 - 皮质 - 丘脑回路可视为核心 “睡眠功能单元”—— 它通过整合丘脑与皮质结构的输入信号,调控 NREM 睡眠中 K 复合体、慢波及纺锤体的核心生成回路,充当着睡眠振荡调控的解剖与功能中枢。
丘脑核团的功能分化可能进一步支持睡眠或麻醉状态下皮质振荡的区域特异性调制。例如,丘脑网状核(TRN)的脑干胆碱能输入被激活时,会诱导类似睡眠的丘脑皮质振荡状态,进而促进 NREM 睡眠(而非 REM 睡眠),这一过程可能通过增加睡眠纺锤波的出现频率,或抑制促进觉醒的丘脑中线回路实现。此外,蓝斑核的去甲肾上腺素能神经元在清醒时放电频率最高,NREM 睡眠期间逐渐减弱,REM 睡眠时则完全沉默。这些发现共同证实,丘脑皮质回路在 NREM 睡眠期间的大脑活动调控中占据核心地位。
二、快速眼动睡眠(REM)中的网络振荡
REM 睡眠期间,皮质脑电图(EEG)记录呈现出显著变化,与人类 N1 期 NREM 睡眠或啮齿动物的清醒状态相似,其核心特征为低电压、高频活动,具体包含 θ 节律(人类 4-6Hz)与 γ 振荡(30-90Hz)。
REM 睡眠的其他典型特征还包括:眼电图(EOG)显示快速且不规则的眼球运动、肌电图(EMG)显示肌肉张力消失、脑部温度升高,以及呼吸与心率的不规则波动。传统观点认为做梦仅发生于 REM 睡眠,但近三年的研究证实,NREM 睡眠期间也可能出现做梦现象。
(1)θ 节律
θ 节律(人类 4-7Hz)是 REM 睡眠期间海马活动的标志性特征,主要分为两类,即 I 型与 II 型,二者的发生场景和功能存在明显差异:
- I 型 θ 节律(5-8Hz):主要出现于动物及人类的运动状态与 REM 睡眠期间(图 2b,图 3a),部分研究证实其与 REM 睡眠中的情境记忆巩固存在因果关联;
- II 型 θ 节律(4-7Hz):常见于恐惧引发的冻结反应及尿烷诱导的全身麻醉状态,不会在睡眠期间出现。
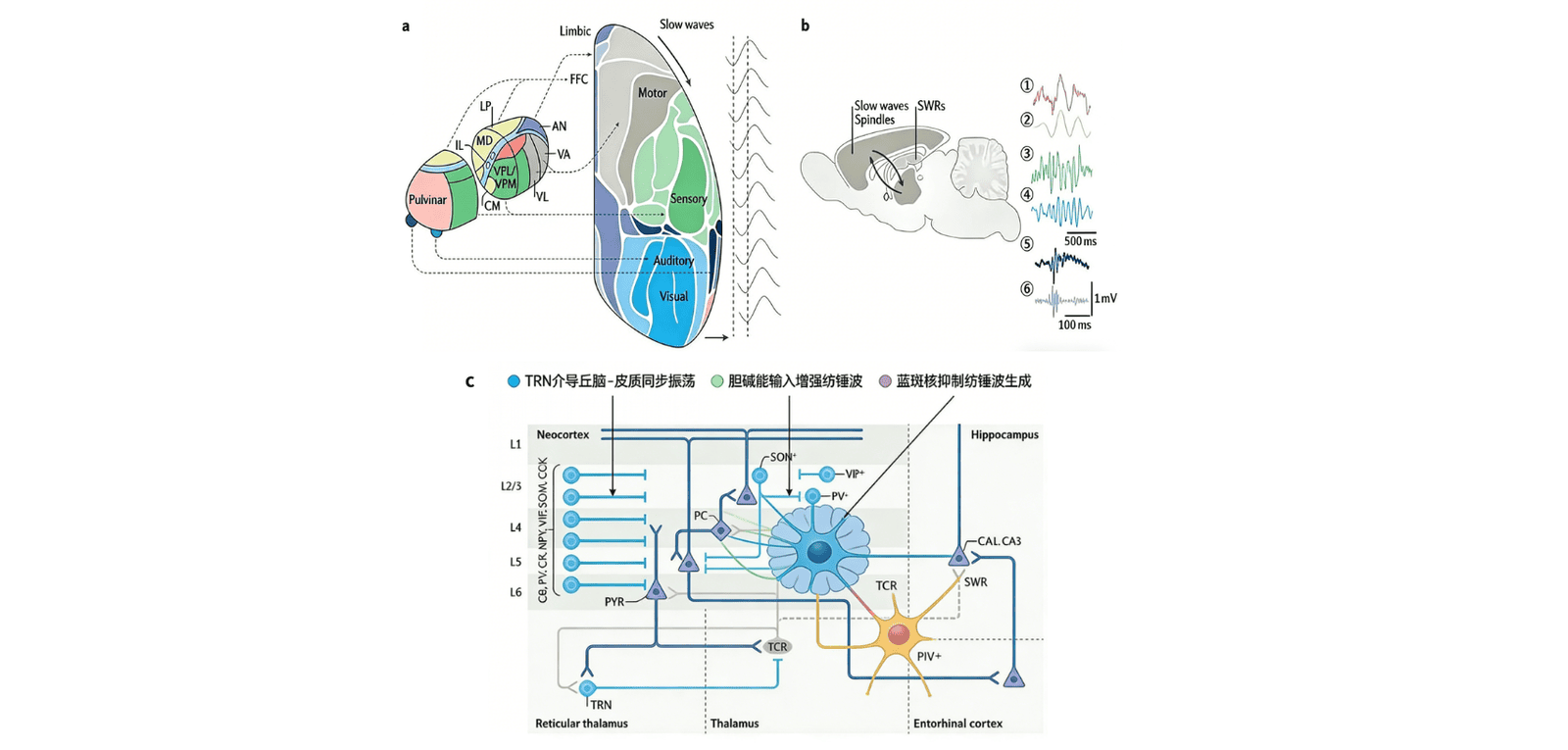
图2 NREM睡眠特异性振荡的回路机制
内侧隔膜包含谷氨酸能、GABA 能及胆碱能神经元,是海马正常 θ 节律活动的必需结构 —— 电解损伤或药物阻断实验已证实这一点(图 3b)。目前关于海马 θ 节律的生成机制已有明确假说:内侧隔区 GABA 能神经元以 θ 频率节律性放电,且与睡眠时海马 θ 节律锁相,其内在的 “起搏器” 节律性源于超极化激活及环核苷酸门控非选择性阳离子通道的表达;这些 GABA 能神经元通过突触后抑制海马中间神经元,最终实现锥体细胞的节律性去抑制。
相比之下,内侧隔区胆碱能神经元的放电模式比 GABA 能神经元更慢,其作用并非驱动海马 θ 节律,而是微调其幅度 —— 具体可增强 θ 节律的强度与连贯性,或减少 θ 周期振荡。此外,内侧隔区谷氨酸能神经元的部分亚群可自发以 θ 频率放电,并投射至海马,通过直接激活 CA3 锥体细胞引入 θ 节律。
来自内嗅皮层、下丘脑后部及脑干回路的额外输入信号,进一步参与 REM 睡眠 θ 振荡的调控过程。因此,REM 睡眠期间的 θ 振荡呈现非线性、动态且短暂的 “相位” 周期,这一特征与脑干起源的瞬态脑桥膝枕叶(PGO)波密切相关。PGO 波的出现会增加海马内部,以及海马与杏仁核等相连脑区之间的 θ 波段同步性,可能对信息传输与记忆巩固起到促进作用。
(2)PGO 波
REM 睡眠脑桥波(传统称为 PGO 波或 P 波)是一种大型相位波,在大鼠、猫及人类的 REM 睡眠期间,可通过脑桥局部场电位(LFP)检测到(图 3b)。早期对猫的实验研究表明,这些波由桥脑网状结构(即尾外侧臂周核与蓝斑下核)内动作电位的同步爆发触发,进而激活桥脚被盖与外侧被盖中的胆碱能神经元,随后引发外侧膝状体与枕叶皮层的激活(图 3b)。
PGO 波的调控涉及乙酰胆碱、GABA、甘氨酸及一氧化氮等多种神经递质,其传播范围覆盖杏仁核、海马及丘脑皮质系统等多个下游靶区。研究表明,PGO 波与神经系统成熟、记忆巩固及视觉感知(包括做梦时的幻视)密切相关,且与 REM 睡眠中的眼动、相位 θ 节律保持一致,对海马依赖型记忆的形成具有重要意义。
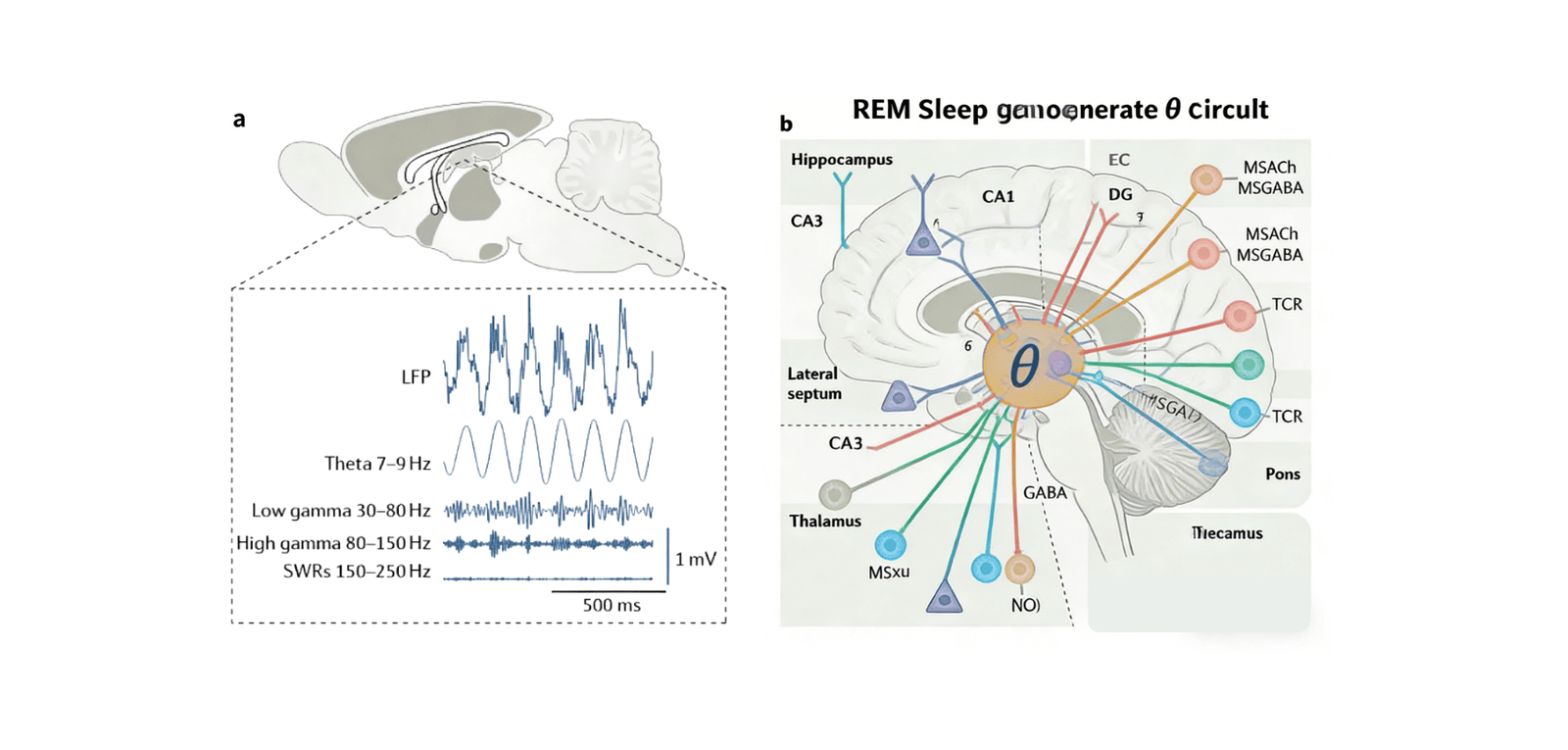
图3 REM睡眠特异性振荡的回路机制
(3)γ 振荡
γ 振荡表现为 30-150Hz 频率范围内的短时或瞬态振荡活动爆发,通常可细分为低频(30-50Hz)、中频(50-80Hz)与高频(80-150Hz)三个亚频带(不同研究的频率界定存在差异,且随脑区不同而变化)。在人类与啮齿类动物的新皮质、海马、杏仁核、纹状体、丘脑及下丘脑等几乎所有脑区,清醒与 REM 睡眠期间均能记录到 γ 振荡。
γ 振荡的产生源于局部神经元组件的同步活动,具体由抑制性中间神经元与突触后 GABAA 受体介导的抑制作用调控,其形成机制主要包括三种模型:仅涉及局部中间神经元耦合的 I-I 模型、涉及锥体细胞与中间神经元延迟反馈的 E-I 模型,或两种机制的结合。其中:
- I-I 模型中,突触耦合中间神经元的放电增加会引发体周抑制性突触后电流,随后 GABAA 受体介导的超极化逐渐衰减,进而形成同步放电,振荡频率由抑制性突触后电位的动力学特征(直接取决于 GABAA 受体的时间常数)与中间神经元的兴奋性共同决定;
- E-I 模型中,兴奋性锥体细胞与抑制性中间神经元的相互突触作用形成延迟反馈,振荡的持续需要一定水平的突触强度,而相位延迟则决定振荡频率。
值得注意的是,多个远端脑区(如下丘脑背侧或视觉皮层的半球间回路)内的局部 γ 振荡可呈现远程同步特征。目前 γ 振荡在睡眠期间的具体功能仍不明确,但有趣的是,当人类在阶段性 REM 睡眠期间接收听觉输入时,若 γ 功率升高,其皮质激活程度会低于强直 REM 睡眠期间接收相同输入的情况 —— 这一发现表明,在清醒经历向睡眠记忆巩固的过程中,γ 振荡可能通过防止觉醒(稳定 REM 睡眠状态)发挥重要作用。
三、快速眼动睡眠(REM)执行回路的作用
从 NREM 睡眠向 REM 睡眠过渡时,皮质脑电图信号会发生特征性变化:海马体、体感皮质及顶叶皮质中的 θ 节律与 γ 振荡逐渐增强,而额叶皮质中的慢波与 δ 振荡则逐渐减弱并最终消失。
尽管 REM 睡眠期间的皮质脑电图信号表面上与清醒状态相似,但区域特异性分析揭示了二者的显著差异:与清醒时的 θ 节律不同,REM 睡眠期间脾后皮质与海马的 θ 节律在回路及单细胞水平均表现出强烈同步性。此外,由于观察到 θ 波可沿啮齿类动物海马的隔颞轴传播,且 REM 睡眠与清醒期间,海马各区域(如 CA1、CA3、齿状回)内部及区域间的 γ 振荡一致性存在显著差异,“REM 睡眠期间整个海马 θ 节律同步” 的传统观点已被重新审视。
与 NREM 睡眠类似,REM 睡眠的执行回路与振荡生成网络之间的调控机制仍存在研究缺口。REM 睡眠执行回路最初发现于脑干,下丘脑与基底前脑回路在此发挥调控作用。因此,REM 睡眠期间的皮质活动主要由皮质下及皮质回路共同产生,具体包括侧背下核、基底前脑、外侧被盖 / 桥脚被盖(胆碱能区域)、屏状核或压后皮质等多个起源部位。其中,乙酰胆碱通过直接作用于生长抑素中间神经元,引发皮质网络的快速 “去同步化”。
此外,下丘脑外侧区已发现可调控 REM 睡眠关键特征(如频率与持续时间)的神经元群,包括黑色素浓缩激素神经元与乳头上核(特别是双核中的谷氨酸能与 GABA 能神经元)。这些神经元群可直接投射至内侧隔膜或齿状回,进而直接调控 REM 睡眠 θ 节律的回路功能。
四、从睡眠到觉醒的过渡过程
从睡眠中醒来后的最初阶段,人类通常会表现出警惕性降低、意识模糊、认知能力受损等特征,这一状态被称为 “睡眠惰性”,通常会在几分钟内逐渐消失。睡眠惰性期间的脑电图显示,后皮质会出现睡眠特异性特征(主要为慢波与低频振荡)的侵入,且 θ 节律持续存在,其强度与先前的睡眠时长、体温的昼夜节律谷值及睡眠阶段相关。
尽管啮齿类动物的睡眠惰性尚未得到系统表征,但通过相关指标可明确其短暂觉醒(持续数秒)的状态:NREM 睡眠或 REM 睡眠中,慢波会突然减少,同时快速振荡(主要为 θ 与 γ 振荡)增强,且可检测到运动活动。
细胞水平上,短暂觉醒发生前,脑干、基底前脑及下丘脑中促进觉醒的神经元会出现放电激增,随后恢复 NREM 睡眠状态。清醒期间,这些细胞与回路的活动会随环境刺激或行为变化呈现区域特异性动态调整,这一时空调控特征与睡眠期间的振荡调控具有相似性。
回路水平上,激活觉醒回路足以诱导从 NREM 睡眠、REM 睡眠或二者共同状态中觉醒;但目前尚未证实任何单个回路是觉醒所必需的 —— 因为与觉醒相关的神经递质或神经调节剂的损伤或药物阻断,均未导致睡眠时长的显著增加。
五、结论与未来展望
振荡是局部产生的节律性活动,可在多个回路中同时发生,并在哺乳动物睡眠大脑中传播不同距离。部分睡眠振荡在清醒期间也可能短暂出现,且具有相同的电生理特征:大多数振荡局限于局部脑回路(如 PGO 波),但也有部分振荡(如慢波)可实现远距离传播。尽管存在这些差异,所有睡眠振荡在睡眠 - 觉醒周期中均会经历精确的时空编排,形成连续的大脑活动动态过程。
对睡眠振荡的局部操纵可显著改变整体睡眠结构,这为理解睡眠相关网络的功能连接提供了重要线索。例如,NREM 睡眠期间,对 GABA 能 TRN 神经元进行光遗传激活或去抑制,会增加丘脑皮质回路中纺锤波的出现频率,同时提升 δ 振荡幅度,最终稳定啮齿类动物的 NREM 睡眠;此外,对动物或人类新皮质局部区域进行电刺激或经颅磁刺激,可引发单一脑电图慢波并加深睡眠。
生理相关的感觉输入(如听觉、嗅觉(仅限大鼠)或前庭刺激)也可稳定并延长睡眠(包括 REM 睡眠),尽管其潜在机制尚未明确,但这些效应可能归因于(感觉诱发的)慢波的产生与全脑传播 —— 这些慢波与高频振荡或与 REM 睡眠执行电路同步的 PGO 波保持协同。最终,直接调控睡眠振荡可能对睡眠状态持续时间及睡眠 - 觉醒周期的整体架构产生即时且持久的影响。
这些发现也带来了重要的研究挑战:核心挑战之一在于深入理解表型相似的睡眠振荡的机制与功能差异(例如,源自皮质或丘脑的慢波是否具有相同功能,目前仍不明确)。
睡眠期间振荡同步的精确模式可能支撑不同睡眠阶段的多种功能。例如,NREM 睡眠期间,皮质 UP 状态的高尖峰与突触活动通常会与纺锤波、尖波涟漪(SWR)、β 振荡及 γ 振荡等高频振荡在时间上同步;近端与远端振荡网络的同步,进一步拓展了振荡调控神经通讯及睡眠相关突触可塑性的复杂机制(目前尚未完全表征)。除上述功能作用外,远程回路的同步还可协调睡眠状态启动、维持与终止的振荡活动。
最后,深入理解多尺度睡眠振荡的起源,有望揭示其对睡眠控制及睡眠功能的影响。以单细胞分辨率解析这些振荡的大规模连接图谱,将为 NREM 或 REM 睡眠提供定量非线性特征,进而完善睡眠状态的定义。新的分析方法(如无监督睡眠分期)与记录、扰动技术(如光遗传学、经颅磁刺激等非侵入性脑调节方法)的结合,有望系统阐明睡眠的神经生物学机制,及其在健康与睡眠 / 意识障碍、癫痫、精神分裂症、重度抑郁症及痴呆相关睡眠振荡早期病理生理学变化中的功能意义。

