脑电图揭秘失眠:高唤醒模型的科学证据与临床希望


失眠本质为24小时过度觉醒障碍
睡眠微结构标记优于宏观参数:传统PSG指标(如总睡眠时间)敏感性低;而EEG微特征(如CAP率增高、REM睡眠不稳定)更精准反映睡眠碎片化和主观睡眠错觉。
清醒期EEG可作生物标志物:静息状态下的高频EEG活动能识别过度觉醒,与前额叶网络激活障碍相关,助力早期诊断。
REM睡眠异常核心关联情绪失调:REM片段化与睡眠误解及情感障碍共病紧密相连,揭示失眠-情绪恶性循环的生理基础。
EEG指导个性化治疗选择:qEEG标记(如频谱功率变化)可预测CBT-I或药物(如DORAs)疗效,推动精准干预。
a.主要内容:基于“过度觉醒假说”,将失眠定义为24小时生理、认知和情绪过度觉醒的状态。支持证据包括:
· EEG研究:显示失眠患者清醒和睡眠期间高频EEG活动(如β和γ波)增加,表明皮质兴奋性增高。
· 神经影像学:失眠患者大脑葡萄糖代谢升高。睡眠误解(主观-客观睡眠差异)可能与REM睡眠碎片化及微觉醒相关。此外,循环交替模式(CAP)分析表明失眠患者CAP率增高,反映睡眠状态不稳定。
· CAP和REM睡眠不稳定可作为客观睡眠质量指标。
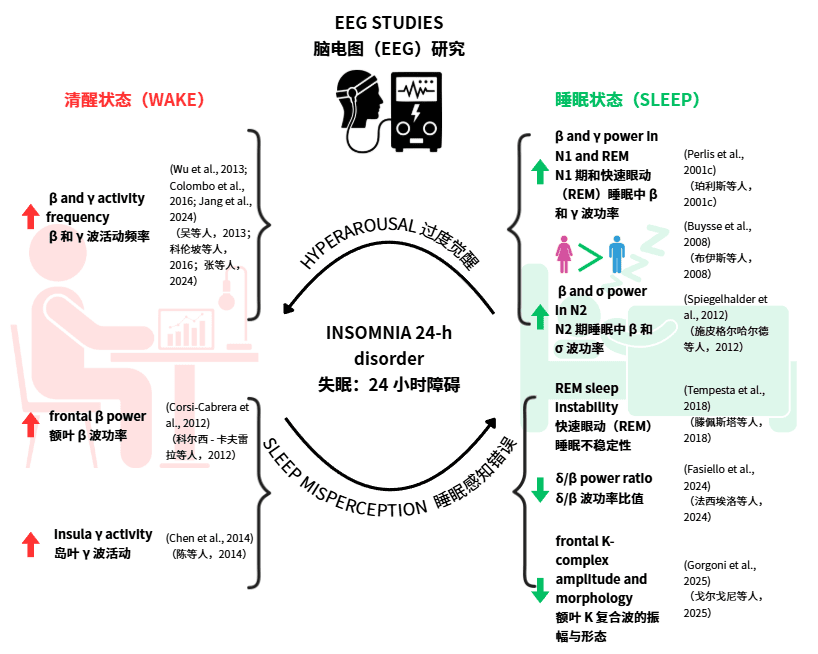
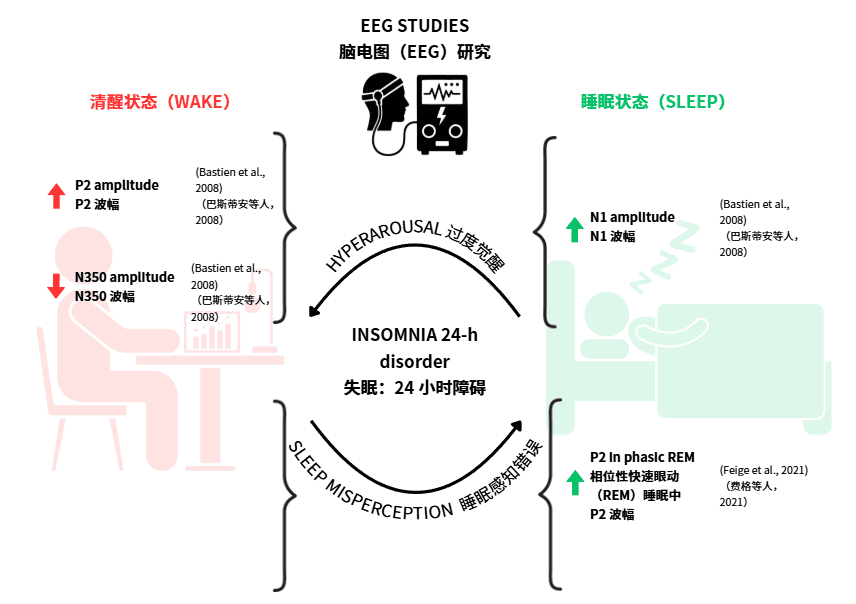
睡眠障碍事件相关电位(ERP)脑电图研究关键发现综述。图例:EEG:脑电图;ERP:事件相关电位;REM:快速眼动睡眠。(3、睡眠期EEG:宏观结构与微结构)
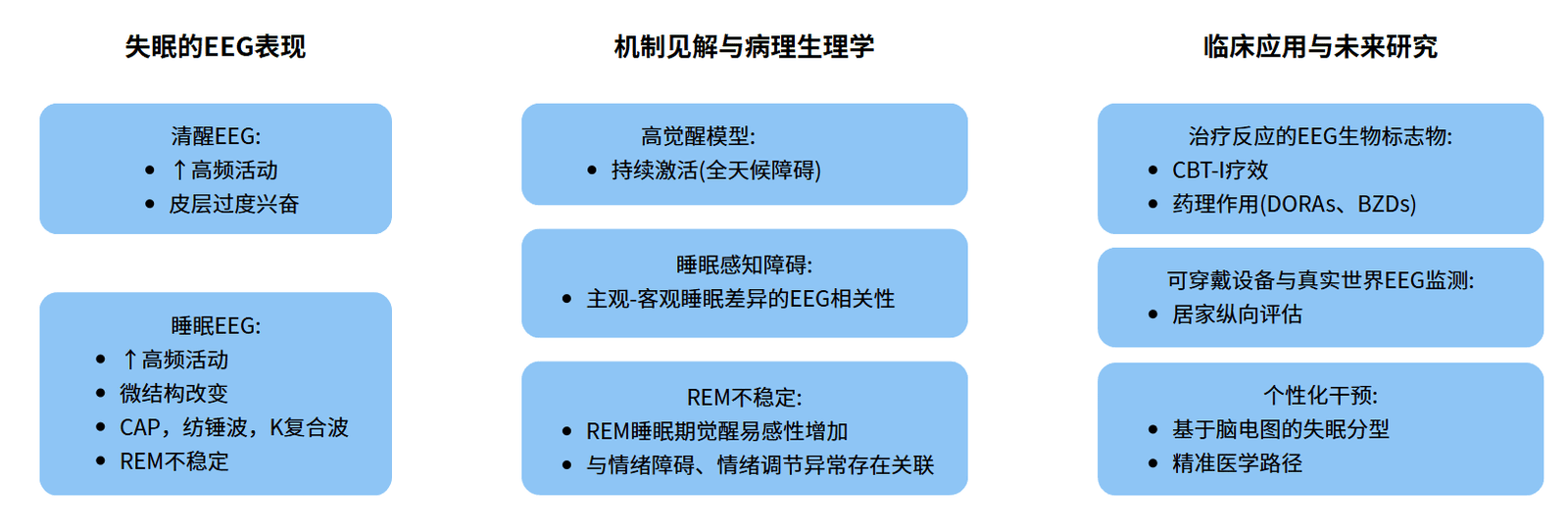
说明:文章为《Sleep EEG in chronic insomnia disorder》(2025综述)总结。

